Kimya Köken Bilimi
Kimya sözcüğüyle simya sözcüğünün aynı kökten geldiği tahmin edilmektedir. 17 yüzyılda kimya ve simya sözcükleri aynı bilimsel disiplini, (maddenin analizi, sentezini içeren çalışmaları) tanımlamak için ayırt edilmeksizin kullanılmışlardır. Ancak 18. yüzyılda bu iki sözcük arasında bir ayrım gözetilmeye başlanmış, simya daha çok metalden altın yapmakla ilgili uğraşları tanımlamak için kullanılmıştır.[3] Simya sözcüğünün Arapça al-kimia (الكيمياء) sözcüğünden türediği[4], bu Arabça sözcüğünde Antik Yunanca himya (metal eritmek alnamına gelen χημεία ya da χημία) sözcüğünden türediği idda edilmektedir.[5]
Tarih
| Element | Polihedron | Yüzey Sayısı | Üçgen Sayısı | |
|---|---|---|---|---|
| Ateş | Tetrahedron |  | 4 | 24 |
| Hava | Octahedron |  | 8 | 48 |
| Su | Icosahedron |  | 20 | 120 |
| Toprak | Küp |  | 6 | 24 |
| Platon'un geometrik elementleri (Atomculuk) | ||||
Simya Öncesi [değiştir]
Kimyanın bilinen tarihi Antik Mısır döneminde başlamıştır. MÖ 2000'li yıllarda Mısırlılar'ın kimyasal yöntemler kullanarak kosmetik tozlar ürettikleri idda edilmektedir.[6] Kral Hamurabi döneminde (MÖ 1792-1750) Babiller altın, gümüş, civa, kurşun, demir ve bakır gibi metalleri tanımlanmış ve bu metallere semboller verilmiştir.[7] Erken Yunan felsefeciler (Sokrates öncesi düşünürler) doğal olayları doğaüstü olmayan nedenlerle açıklamaya çalışmışlar[8], bunun sonucunda da bu dönemde simya öncesi kimya biliminin temelleri atılmıştır. Miletli Tales (MÖ 624 – MÖ 546) maddenin presiplerini araştırmış ve suyun evrenin temel maddesi olduğunu öne sürmüştür.[9] Bir diğer Miletli Anaksimandros (MÖ 610- MÖ 546) suyun karşıtı olan ateşin nasıl oluştuğunu sorgulamıştır.[10] Empedokles (MÖ 490-430) evrenin 4 temel element ateş, hava, su ve topraktan oluştuğunu idda etmiştir.[11] Empedokles'in tanımına göre toprak katı maddeleri, su sıvı maddeleri ve metalleri, hava gasları ifade etmekteydi. Bununla beraber ateşide bir süreçten çok sıvı,gaz ve katı gibi maddenin bir hali olarak tanımlamıştır. Demokritos'un hocası Leukippos evrenin iki çeşit elementten oluştuğunu (boşluk ve katı) ifade etmiş, boşluğun ve katılığın evrendeki tüm elementleri oluşturduğunu ifade etmiştir.[12] Democritus (MÖ 460-370 ) Leukippos ile birlikte atomcu teoriyi geliştirmiştir. [13] Maddelerin yapı taşı olarak daha küçük parçalara ayrılamayan atomlar Leucippus ve Democritus'un geliştirdiği bir felsefe sistemi olarak kabul edilmesine rağmen Platon bu atomculuk teorisine bölünemezlik prensibini eklemiştir. Plato evreni oluşturan 4 temel elementin geometirik katılardan oluştuğunu bu katılarında üçgen yüzeylerden oluştuğunu idda etmiştir. [14] Aristoteles (MÖ 384-323) elementlerin özellikleri düşüncesini geliştirmiştir. Farklı elementlerin farklı özellikleri olduğunu ve bunun çeşitli nicel değişkenlere bağlı olduğunu ifade etmiştir. Bu nicel özellikleri değiştirildiğinde bir elementin başka bir elemente dönüştürülebileceğini ve maddelerin değişim halinde olduğunu idda etmiştir.[15]Simya Dönemi [değiştir]
Aristotalesin fikirlerinden etkilenen simyacılar (yaklaşık MÖ 320, MS 300) yılları arasında Yunanca konuşulan akdeniz kıyılarında, Mısır'da, İran'da Aristotales ve diğer Yunan filozofların teorilerini pratiğe geçirmeye başlamışlardır.[16] [17] Yine bu dönemde ilk defa simyacılar ucuz metallerden altın elde etmeyi mümkün kılması düşünülen felsefe taşını üretmeye çalışmışlardır.[7]
13. yüzyıla gelindiğinde simya tüm Avrupa kıtasında yaygın bir hale gelmiş, örneğin dönemin önemli bilim adamlarından Raymundus Lullus[18] İngiltere kralı tarafından İngiltere'ye basit metalden altın üretmesi için davet edilmiştir.[7] 13. yüzyılın başlarında dönemin ünlü simyacıları Roger Bacon[19] (1214/1220–1292), Albertus Magnus[20], ve Raymundus Lullus basit metalden altın üretme yöntemleri dışında simyanın diğer alanlarına yönelip, simyanın günümüz kimyasına yaklaşmasına öncü olmuşlardır.[21]
14. yüzyılda Katolik Kilisesi simya karşıtı taraf olmuş ve 1317 yılında Papa John XXII simyacılığı yasaklamıştır.[22]
17. yüzyıla gelindiğinde simya göreceli olarak az da olsa hala varlığını sürdürmekteydi. 17. yüzyılın etkin bilim adamlarından Robert Boyle 1661 yılında döneminde büyük yankı uyandıran eseri The Sceptical Chymist'i yayımlamıştır.[23] Aristotales'in 4 element teorisini ret eden bu kitap aynı zamanda simyanın döneminin de sona erdiğini işaret etmekteydi.[24]
Simya döneminde simyacıların araştırmaları ve deneyleri vasıtasıyla birçok laboratuvar tekniği geliştirilmiş ve çeşitli bileşik ve elementler keşif edilmiştir.[5]
Geleneksel Kimya [değiştir]
Bu dönem 17. yüzyıl sonuyla 19. yüzyıl başlarına denk gelmektedir. Johann Joachim Becher 17. yüzyıl ortalarında yanma ile ilgili Phlogiston teorisini geliştirmiştir. Bu teoriye göre her yanıcı madde phlogiston diye adlandırılan kokusuz, renksiz, tatsız ve ağırlıksız bir içerik içermekteydi ve bu içerik yanma gerçekleştiğinde yanıcı madde tarafından ortama salınmaktaydı.[25]Bu teori daha sonra Georg Ernst Stahl tarafından daha popüler bir hale getirilmiş 18. yüzyılın büyük bir kısmında genel kabül görmüştür. [26] 1785 1787 yılları arasında Fransız fizikçi Charles Augustine de Coulomb günümüzde Coulomb yasası olarak adlandırılan benzer yüklü maddelerin birbirini ittiği karşıt yüklülerin birbirini çektiği ve bu çekim ya da itim kuvvetinin hesaplanması için gerekli denklemi de içeren kanunu bulmuştur.[27] Phlogiston teorisi 18. yüzyılın sonlarına gelindiğinde Lavoisier tarafından çürütülmüştür. Daha önceden Phlogiston teorisine göre de-phogiston maddesi olarak adlandıralan maddenin oksijen olduğunu keşfetmiştir.[28] 1803 yılında John Dalton atom teorisini kraliyet enstitünde ilk kez sunmuştur. Bu teoriye göre farklı elementlerin atomları, farklı ağırlıklara sahiptirler. Bu teorinin bazı ilkeleri;
- Bütün maddeler atomlardan meydana gelmektedir.
- Atomlar daha küçük parçalara ayrılamazlar.
- Aynı elementin bütün atomları birbirinin aynısıdır.
- Farklı elementler farklı atomlara sahiptir.
- Atomların yeniden düzenlenmesi sonucu kimyasal tepkimeler meydana gelir.
- Bileşikler elementlerden meydana gelirler.
Modern Kimya [değiştir]
Bu dönem 19. yüzyıl ve sonrasını kapsar. Heinrich Geißler (1814-1879) 1854 yılında suyun en yüksek yoğunluğa 3.8 C° ulaştığını kendi icat ettiği bir mekanizmayla göstermiştir (daha sonra bu sıcaklığın 3.98 C° olduğu bulunmuştur).[31] Daha sonra Geisslerin icat ettiği vakum tüpüyle William Crookes atom teorisinde ilerlemeler kaydetmiş ve Cathode ray'i keşfetmiştir.[32]Eugene Goldstein(1850-1930)'ın çalışmaları protonun varlığını ispatlamıştır.J. J. Thomson (1856 – 1940) kendi atom modelini geliştirmiş ve 1906 yılında Nobel fizik ödülünü kazanmıştır.[33] Mendeleyev periyodik tabloyu 1869 yılında Kimyanın Prensipleri adlı eserinde yayımlamıştır. Bu periodik tabloda bilinen 63 elementi atom ağırlıklarına ve benzer özelliklerine göre sıralamıştır.[34] Marie Curie (1867 – 1934) radyoaktiviteyi ve sonrasında Polonyum ve Radyum'u keşetmiştir. [35] 1911 yılında Nobel kimya ödülünü kazanmıştır.[36] Ernest Rutherford 3 çeşit radyoaktifliği alfa parçacığı (+), beta parçacığı (-) ve gama ışınını keşfetmiştir.[37] [38] [39] Bu gelişmelerin sonrasında ve öncesinde daha birçok bilim insanının katkısıyla kimya bilimi günümüze ulaşmıştır. 2011 yılı Birleşmiş Milletler tarafından uluslararası kimya yılı ilan edilmiştir.[40]
Temel Kavramlar ve Konular
Asitler ve Bazlar [değiştir]
| Tanım | Asit Baz Tepkimeleri | |||
|---|---|---|---|---|
| Bronsted-Lowry tanımına göre |  | |||
| Lewis tanımına göre | 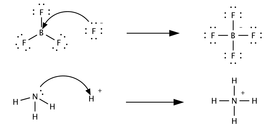 | |||
| Asit-Baz Temel Tanımlar | ||||
- Asit, suda çözüldüğünde çözeltiye H+ bırakan maddelerdir
- Baz ise, OH- bırakan maddelerdir.[45]
- Asit, proton (H+) bırakan maddelere denir.
- Baz, proton kabul eden maddelerdir.[46]
- Asit, H+ iyonu gibi, çözeltiden elektron eksilten maddelerdir [47]
- Baz ise, electron veren maddelerdir. Diğer tanımlardan farklı olarak sadece elektron alışverişi üzerine kurulmuş bir tanımlamadır.[48]
Asit-Baz Tepkimeleri [değiştir]
- HCl + NaOH → NaCl + H2O
Atomun Yapısı [değiştir]
- Her kimyasal element küçük, bölünemeyen atom olarak adlandırılan parçacıklardan oluşmaktadır.
- Aynı elementin atomları bir birine ağırlık ve özellikleri bakımından benzerdirler, fakat farklı elementlerin atomları birbirinden farklıdırlar.
- Herhangi bir bileşik oluşurken, farklı elementler basit bir sayısal oranda birleşirler. Örneğin A atomu B atomuyla birleşip AB bileşiğini oluşturuyorsa, 2AB bileşiğini oluşturmak için 2A 2B'ile tepkimeye girmek zorundadır.[51]
- Modern atom teorisi öncesi atom modelleri
| Parçacık | Kütle | Yük | Anti Parçacık | Sembol | Keşif | Teori |
|---|---|---|---|---|---|---|
| Nötron | 1.674927351(74)×10−27 kg[56] | 0 | Antinötron | n0 | James Chadwick (1932)[57] | Ernest Rutherford (1920)[57] |
| Proton | 1.672621777(74)×10−27 kg[56] | +1 e 1.602176565(35)×10−19 C | Antiproton | p+ | Ernest Rutherford (1917–1919, isimlendirilmesi; 1920) | William Prout (1815) |
| Elektron | 9.10938291(40)×10−31 kg[56] | −1 e −1.602176565(35)×10−19 C | Pozitron | e | J. J. Thomson (1897) | G. Johnstone Stoney (1874) |
| Atomun temel parçacıkları | ||||||
Moleküllerin yapısı [değiştir]
Moleküler Bağlar [değiştir]
Moleküller Arası Kuvvetler [değiştir]
Moleküller arası kuvvetler, bir bileşiğin molekülleri arasında bulunan çekim kuvvetleridir. Bu kuvvetler bir bileşiğin katı, sıvı ya da gaz halinde bulunmasında, kaynama ve erime noktalarının değerinde ve çözünürlüğünde önemli rol oynar.[62] Moleküller arası kuvvetler Van der Waals kuvvetleri, ve hidrojen bağıdır.[63]Bileşikler [değiştir]
Bileşik Çeşitleri [değiştir]
| Tanım | Kimyasal Formül | |||
|---|---|---|---|---|
| Empirik Formül | CH2O | |||
| Moleküler Formül | C2H4O2 | |||
| Yapısal Formül | ||||
| Asetik Asit | ||||
- Empirik formül molekül hakkında çok fazla bilgi vermemekle birlikte sadece elementlerin orantısal sayılarını vermektedir. Örneğin, CH2O empirik formülü hem C2H4O2 hem de C6H12O6 molekülleri için aynıdır.
- Moleküler formül molekülü oluşturan elementlerin sayılarını vermektedir. C6H12O6 moleküler fomüle örnektir.
- Yapısal formül ise molekülün içerisindeki bağlarıda göstermektedir.
Çözeltiler [değiştir]
Çözünürlük [değiştir]
olarak sıralanabilinir.[67]
Elektrokimya [değiştir]
Kimyasal Bağlar [değiştir]
Kinetik [değiştir]
Stokiyometri [değiştir]
- CH4 + 202 → 1CO2 + 2H2O
Termodinamik
Kimyanın Temel Kanunları
- Avogadro yasası
- Boyle yasası
- Charles yasası
- Gay-Lussac yasası
- Enerjinin korunumu yasası
- Kütlenin korunumu yasası
- Dalton yasası
- Sabit oranlar yasası
- Dulong–Petit yasası
- Faraday'ın elektroliz yasası
- Gay-Lussac yasası
- Graham difüzyon yasası
- İdeal gaz yasası
- Katlı oranlar yasası
- Peryodik tablo yasası












Hiç yorum yok:
Yorum Gönder